Proteinforschung
Krebsförderndes Ras-Protein liegt in Zellen im Doppelpack vor
Beinahe alle Versuche, das Ras-Protein als Angriffsstelle für Medikamente zu nutzen, schlugen bislang fehl. Neue Erkenntnisse über seine Struktur wecken Hoffnung auf Optionen für die Medikamentenentwicklung.
Forschende aus Bochum und Osnabrück haben neue Einblicke in die Struktur des Ras-Proteins gewonnen, das als molekularer Schalter des Zellwachstums fungiert und an der Entstehung von Krebs beteiligt ist. Mithilfe von Fluoreszenzmarkierungen wiesen sie nach, dass sich das Protein als Doppelpack an die Zellmembran anlagert, und zwar genau mit der Struktur, die sie bereits 2012 theoretisch vorhergesagt hatten. Das Team vom Bochumer Zentrum für Proteindiagnostik (PRODI) hofft, dass diese Erkenntnisse einen neuen Ansatz für die Entwicklung von Krebs-Medikamenten eröffnen. Die Ergebnisse publizierten die Forschenden der RUB und der Universität Osnabrück im Journal of Chemical Science im Mai 2021.
Im Doppelpack stärker
Fehlfunktionen des Ras-Proteins können dazu führen, dass es im eingeschalteten Zustand verbleibt oder sich stark verzögert abschaltet. Das verursacht unkontrolliertes Zellwachstum und in der Folge Krebs. Studien haben gezeigt, dass durch die Zusammenlagerung von Ras zum Doppelpack das Signal für das Zellwachstum deutlich besser weitergeleitet wird.
„Würde man eine Möglichkeit finden, die Doppelpack-Bildung von fehlfunktionierenden Ras-Proteinen mit einem Wirkstoff zu stören, würde deren Signal für das Zellwachstum deutlich abgeschwächt,“ sagt Prof. Dr. Klaus Gerwert, Gründungsdirektor von PRODI. „Daher bietet das Wissen um die Ras-Doppelpackstruktur einen neuen Ansatzpunkt für Wirkstoffe gegen Krebs.“ Bioinformatische Methoden könnten bei der Suche nach potenziellen Wirkstoffen helfen. „Dafür muss allerdings die genaue Struktur der Schnittstelle zwischen den beiden Ras-Proteinen bekannt sein“, erläutert Dr. Till Rudack, Erstautor der aktuellen Studie.
Viele verschiedene widersprüchliche Doppelpack-Modelle
2012 ermittelte die Bochumer Gruppe um Klaus Gerwert mit einer selbst entwickelten Kombination von computergestützten und experimentellen Methoden eine Struktur für den Ras-Doppelpack an der Zellmembran. Mit biomolekularen Simulationen sagte die Gruppe außerdem ein erstes Modell der Schnittstelle zwischen den beiden Proteinen vorher. Die exakte Struktur der Schnittstelle wurde in den folgenden Jahren jedoch kontrovers diskutiert, und viele weitere widersprüchliche Strukturmodelle vorhergesagt. „Um die Kontroverse aufzulösen, sind experimentelle Daten zur eindeutigen Validierung der Modelle nötig“, so Privatdozent Dr. Carsten Kötting, Projektgruppenleiter am PRODI. Diese Daten lieferten die Forschenden in ihrer aktuellen Arbeit und bestätigten ihre bereits 2012 vorhergesagte Struktur.
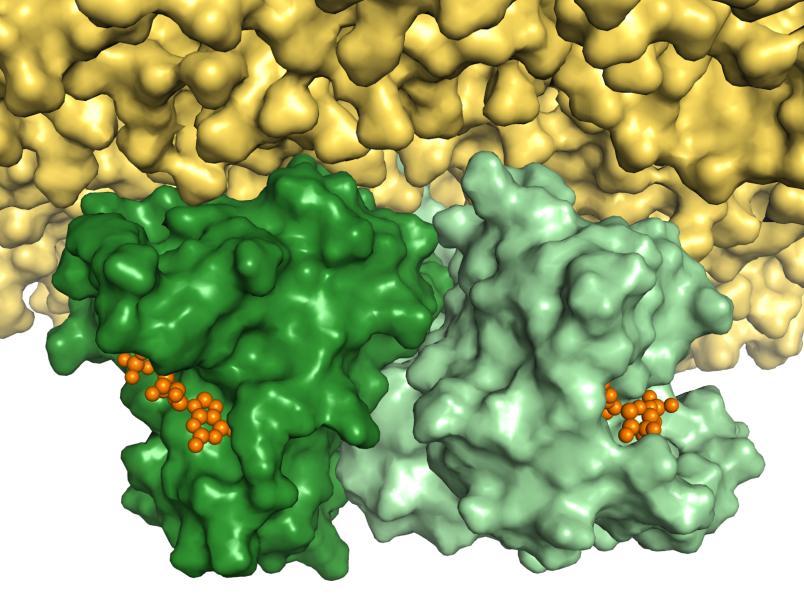
In weiteren Versuchen tauschten die Forscher zwei der wichtigsten Aminosäuren an der Kontaktstelle zwischen den beiden Ras-Proteinen aus. Das Ergebnis: Es bildete sich kein Doppelpack mehr. „Dass wir die Bildung eines Doppelpacks durch den Austausch von Aminosäuren verhindern konnten, stimmt mich optimistisch, die Kontaktstelle des Ras-Doppelpacks in Zukunft als Angriffspunkt für Wirkstoffe nutzen zu können“ gibt Klaus Gerwert einen Ausblick.