Proteinforschung
Wie Algen pinke Pigmente herstellen
Ein Enzym ist der Schlüssel zur Farbe bestimmter Algen. Und damit auch zu ihrer Fähigkeit zur Fotosynthese.
Aus ein- und demselben Vorläufermolekül können Algen verschiedenfarbige Pigmente herstellen – ganz nach Bedarf in ihrer Umgebung. Wie die Synthese des pinken Farbstoffs Phycoerythrobilin im Detail abläuft, konnte ein Team der Fakultät für Biologie und Biotechnologie der Ruhr-Universität Bochum (RUB) und der Technischen Universität Kaiserslautern zeigen. Die Forscherinnen und Forscher fanden heraus, dass ein Schlüsselenzym die Bindung eines Substrats nur in einer unerwarteten Orientierung zulässt und somit für die entsprechende Farbe sorgt. Das Forschungsteam berichtet im Journal of Biological Chemistry vom 20. September 2019. Die Ergebnisse wurden für das Titelbild der Zeitschrift ausgewählt.
Pigmente mit großer Farbvielfalt
Für das Farbspiel von Algen sind natürliche Pigmentmoleküle verantwortlich, die je nach Umgebung gezielt von den Organismen hergestellt werden. Erst mit ihrer Hilfe können die Algen Fotosynthese betreiben. Vor allem Cyanobakterien (früher Blaualgen genannt), Rotalgen und sogenannte Cryptophyten nutzen dazu Biline. Anders als der bekannte grüne Blattfarbstoff Chlorophyll sind Biline Pigmentmoleküle mit großer Farbvielfalt. Biliverdin entsteht durch enzymatisches Aufschneiden der Ringstuktur von Häm und dient als Vorläufer für alle weiteren Biline.

In den nächsten Schritten werden Elektronen und Protonen gezielt an verschiedenen Positionen der Zwischenprodukte angelagert. „Faszinierend dabei ist, dass strukturell sehr ähnliche Enzyme, sogenannte Bilinreduktasen, verschiedenfarbige Pigmente generieren können“, so Johannes Sommerkamp aus der Arbeitsgruppe von Prof. Dr. Eckhard Hofmann an der RUB. „Noch verstehen wir nicht richtig, wie diese Kontrolle der chemischen Reaktionen erfolgt.“
Johannes Sommerkamp hat speziell die Synthese des pinkfarbenen Phycoerythrobilin untersucht. „Phycoerythrobilin wird in Algen normalerweise in zwei Schritten von zwei verwandten Enzymen synthetisiert. Die Struktur des Enzyms für den ersten Schritt konnten wir schon vor einigen Jahren aufklären, aber wir konnten damit nicht verstehen, warum das Enzym für den zweiten Schritt so spezifisch arbeitet“, so Eckhard Hofmann.
Räumliche Struktur gibt Reaktion vor
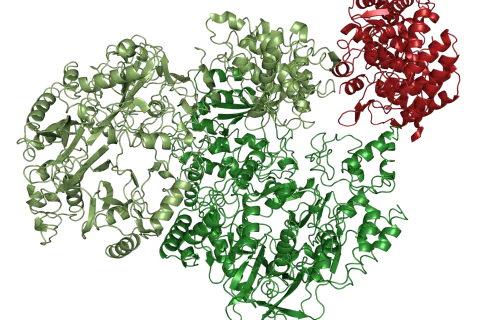
Johannes Sommerkamp gelang es jetzt, die dreidimensionale Raumstruktur des zweiten Enzyms aus der Cryptophyte Guillardia theta zu entschlüsseln. Er nutzte dafür die Röntgenstrukturanalyse, bei der zunächst Kristalle des Enzyms gezüchtet werden, um diese dann mit Röntgenstrahlung zu untersuchen. Auf Grundlage dieser Daten kann dann ein Modell des Enzyms mit atomarer Auflösung erstellt werden. Dabei fanden die Forscher eine unerwartete Orientierung des Vorläuferpigmentes in der Bindetasche, und eine katalytisch wichtige Aminosäure, die eine zentrale Rolle bei der Steuerung der Reaktivität einnimmt.
„Wenn wir uns jetzt die räumliche Struktur der Bindetasche ansehen, passt das Substrat nur in dieser Orientierung. Das legt dann auch fest, wie die Reaktion abläuft“, so Eckhard Hofmann.