
Lösungsmittelchemie Der doppelte Mantel um Moleküle in Wasser
Die Einbettung von hydrophoben Molekülen in Wasser sieht im Detail ganz anders aus als bisher angenommen.
Wasserabweisende Moleküle sind im Wasser von einer Ummantelung aus zwei verschiedenen Schichten umgeben: Die innere Lage bildet ein zweidimensionales Netzwerk. Darüber liegt eine Übergangsschicht, die eine stärkere Bindung zum umgebenden Wasser hat. Bisher hatte man angenommen, dass in der innersten Schicht um solche wasserabweisenden Moleküle tetraedrische, eisähnliche Formationen von Wassermolekülen überwiegen. Das Gegenteil ist der Fall. Die neuen Erkenntnisse hat das Team von Prof. Dr. Martina Havenith, Leiterin des Bochumer Lehrstuhls für Physikalische Chemie II und Sprecherin des Exzellenzclusters Ruhr Explores Solvation an der Ruhr-Universität Bochum (RUB) in der Zeitschrift The Journal of Physical Chemistry Letters am 18. Juni 2020 veröffentlicht.
Einblicke mit Thz-Spektroskopie und Simulationen
In der Arbeit untersuchten die Forscherinnen und Forscher das Wasserstoffbrückennetzwerk rund um den hydrophoben gelösten Alkohol tert-Butanol. Alkohole dienen der Forschung als einfaches Modell für wasserabweisende Moleküle. Das Team kombinierte Ergebnisse der Terahertz (THz)-Spektroskopie und von Simulationen.
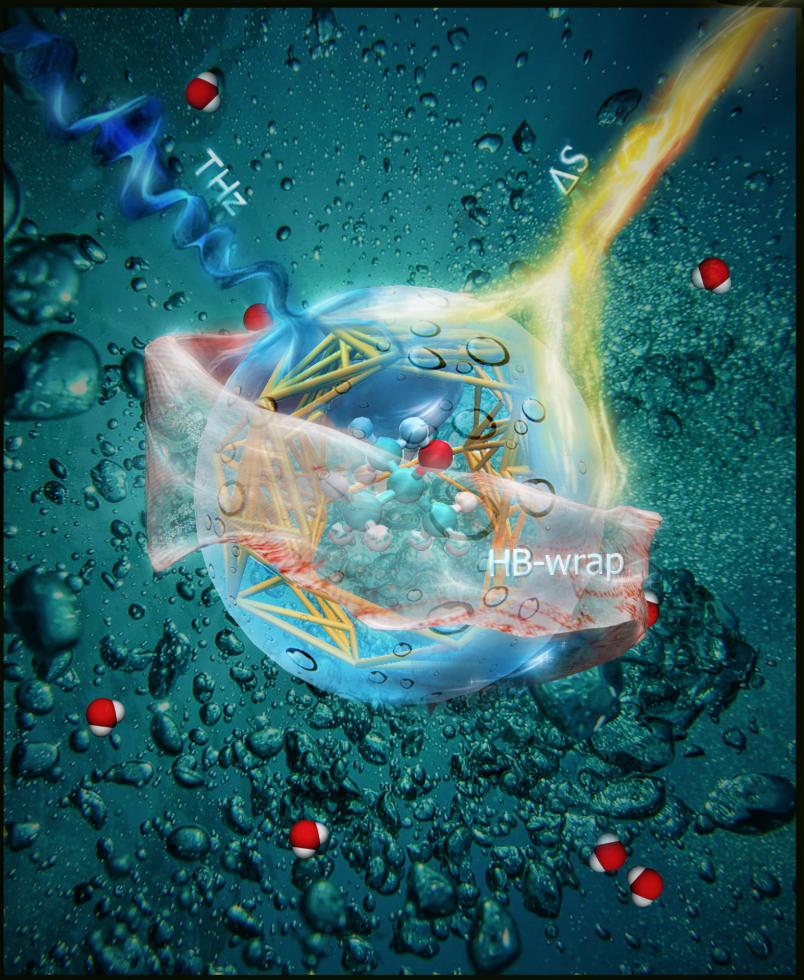
Bei der THz-Spektroskopie schicken Forscher Strahlung im THz-Bereich in die Probe, welche einen Teil der Strahlung absorbiert. Das Absorptionsmuster, das die Chemiker in Form eines Spektrums darstellen, ist wie ein Fingerabdruck des Wassernetzwerks.
Eine dünne Schicht
So entstand ein detailliertes Bild der das Molekül umgebenden Wasserschichten. „Wir nennen die innerste Lage ‚HB-wrap’, wobei HB für water hydrogen bond, also Wasserstoffbrückenbindung steht“, erläutert Martina Havenith. Die darüber liegende Schicht wird als „HB-hydration2bulk“ bezeichnet, also die Verbindung zum restlichen Wasser („bulk“). Beide Lagen der Ummantelung zusammen sind teilweise nur so dick wie eine einzelne Schicht Wassermoleküle. „Es kann vorkommen, dass ein Wassermolekül beiden Schichten angehört“, so Havenith.
Innere Schicht bleibt länger stabil
Bei Temperaturerhöhung schmilzt zuerst die äußere Schicht, die innere hält sich länger um das Molekül. „Das liegt daran, dass die innere Schicht durch die wasserabweisenden Eigenschaften des umschlossenen Moleküls weniger Bewegungsfreiheit hat“, erklärt die Forscherin. „Die einzelnen Wassermoleküle müssen sich stets davon abwenden, daher bilden sie nur ein zweidimensionales, loses Netz.“ Die Moleküle darüber haben mehr Freiheiten und daher auch mehr Verbindungsmöglichkeiten untereinander, die Forscher sprechen von größerer Entropie.
Diese Art der Wechselwirkung ist unter anderem bedeutend für Faltungsprozesse von Proteinen und die biomolekulare Erkennung zwischen einem Medikament und seinem Targetmolekül. Ein Verständnis der Rolle des Wassers spielt dabei eine zentrale Rolle.





