Proteinforschung
Entwicklung von Alzheimer-Plaques mit Infrarot-Mikroskopie aufgeklärt
Man kann dem Menschen nicht einfach in den Kopf schauen. Das macht es schwierig zu verstehen, was im Gehirn von Demenzkranken passiert. Eine neue Methode verschafft Einblicke.
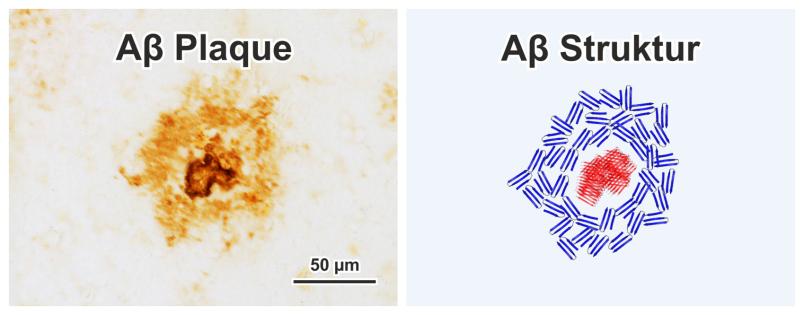
Bei Alzheimerkranken lagert sich das Protein Amyloid-β (Aβ) im Gehirn zu sogenannten Fibrillen zusammen. Dies hat toxische Folgen für die umliegenden Nervenzellen. Man vermutet, dass Immunzellen die Aβ-Fibrillen zu Plaques verdichten. Die Entstehung dieser mikroskopisch kleinen Gebilde konnte jetzt beim Menschen mit Infrarot-Mikroskopie nachverfolgt werden. Ein Forschungsteam der Ruhr-Universität Bochum (RUB) und der Vrije Universität Amsterdam (VU) hat die Entwicklungsstadien der Aβ-Fibrillen bestimmt und so die Entstehung der Plaques nachvollziehen können. Die Forscherinnen und Forscher berichten in der Fachzeitschrift Acta Neuropathologica Communications vom 11. Dezember 2020.
Mit gebündelten Kräften
Das Team vom Zentrum für Proteindiagnostik (Prodi) der RUB arbeitet mit dem medizinischen Zentrum der Vrije Universität Amsterdam (VUmc) zusammen, um die Expertise aus Protein- und Demenzforschung zu bündeln. Medizinische Expertinnen und Experten wie Baayla Boon vom VUmc begleiten Demenzkranke im Alltag und sammeln das Hirngewebe verstorbener freiwilliger Spender. Daraus werden hauchdünne Schnitte für die Untersuchungen angefertigt. „Solche Gewebeschnitte geben Einblick in das Innerste der Hirnwindungen“, sagt Prof. Dr. Annemieke Rozemuller, Leiterin des Lehrstuhls für Pathologie an der VU.

Bei regelmäßigen Treffen tauschen die Gruppen Proben und Erkenntnisse aus. In Bochum untersuchen Proteinforscherinnen und -forscher um Prof. Dr. Klaus Gerwert, Leiter des Lehrstuhls für Biophysik und Gründungsdirektor von Prodi an der RUB, das Hirngewebe. Die darin enthaltenen Plaques werden in speziellen Mikroskopen mit infraroter Strahlung durchleuchtet. „Damit können wir die Faltung von Biomarker-Proteinen im Gewebe bestimmen“, sagt Dominik Röhr von Prodi.
Eine neue Zeitrechnung für Plaques
Die Umfaltung des Aβ-Proteins führt zu langen Fibrillen, wie aus Laborexperimenten bekannt ist. Zunächst faltet Aβ sich wie ein Blatt Papier zu sogenannten β-Faltblättern um. Diese lagern sich zu kleinen Gruppen zusammen, die man Oligomere nennt. Im Laufe der Zeit legen sich die β-Faltblätter wie in einem Kartenstapel zu Fibrillen zusammen. Die Bochumer Forscher um Klaus Gerwert betrachten diesen Prozess als eine Art innere Uhr der Plaques. Neu entstandene Plaques enthalten noch viele Oligomere. Im Verlauf der Plaque-Entwicklung entstehen daraus fortlaufend Fibrillen. Die Wissenschaftler konnten so zeigen, dass Plaques während ihrer Entwicklung verschiedene Stadien durchlaufen. „Die Entwicklung der Plaques konnte bisher nicht direkt beobachtet werden. Durch die Kombination von Methoden aus Medizin und Physik eröffnen sich nun neue Möglichkeiten“, so Klaus Gerwert.
Wissen für den Kampf gegen Alzheimer
Beim Kampf gegen Alzheimer steht Aβ im Fokus. Ein zentraler Ansatz bei der Suche nach einem Heilmittel ist es, die Plaques im Gehirn der Patienten aufzulösen. „Eine frühe Diagnose von Alzheimer ist dabei entscheidend, um zu verhindern, dass Aβ im Gehirn irreparablen Schaden anrichtet“, so Dominik Röhr. Aktuell befinden sich vielversprechende Medikamente in der Zulassungsprüfung. Darunter der Antikörper Aducanumab, welcher Plaques in Gehirn auflösen kann. Die neuen Erkenntnisse aus der Infrarot-Mikroskopie legen nahe, dass die Entwicklung von Plaques frühzeitig gestoppt werden könnte, indem man die Entstehung von Oligomeren verhindert. Diese gelten als besonders schädlich für das Gehirn. Mit entsprechenden Wirkstoffen könnte so die toxische Wirkung von Aβ minimiert werden.