Biokatalysatoren
Leistungsstarke Enzyme aus Algen
Enzyme helfen bei der Herstellung von Lebensmitteln, sind in Waschmitteln vorhanden, werden in der medizinischen Diagnostik eingesetzt – und sie haben das Potenzial, Energieprobleme zu lösen.
Die belebte Welt, wie wir sie kennen, existiert nur, weil bestimmte Enzyme chemische Reaktionen ausführen. Vom einfachsten Einzeller bis hin zu solch komplexen Wesen wie dem Menschen wandeln Enzyme beispielsweise Nahrung in Energie um. Die Fähigkeit, komplizierte chemische Reaktionen mit relativ wenig Energie- und Ressourcenaufwand zu katalysieren, macht Enzyme auch für biotechnologische Anwendungen interessant – zum Beispiel für die Produktion von Medikamenten, Feinchemikalien oder umweltfreundlichen Treibstoffen.
Angesichts der Probleme, welche die Nutzung fossiler Brennstoffe mit sich bringt, wie etwa Luftverschmutzung und Treibhauseffekt, und der Tatsache, dass diese Energieträger zudem bald ausgeschöpft sein werden, benötigen wir dringend Alternativen.
Energiesparender als industrielle Katalysatoren
Die meisten Enzyme sind Proteine, sie bestehen also aus Ketten von Aminosäuren. Häufig finden sich aber auch Nicht-Protein-Komponenten in ihnen. Diese sogenannten Co-Faktoren enthalten oft Metallatome wie Eisen, Kupfer oder Zink und sind für die Biokatalyse unabdingbar.
Wie wichtig solche Metalle in der Biologie sind, zeigt auch ein Vergleich von Natur und Industrie: Der industrielle Prozess, in dem Stickstoff in Ammoniak umgewandelt wird (Haber-Bosch-Verfahren), funktioniert nur bei hohem Druck von etwa 300 bar und hohen Temperaturen um die 450 Grad Celsius. Demgegenüber arbeitet der metallhaltige Biokatalysator, den Bakterien für diese Reaktion verwenden, bei Umgebungsdruck und Umgebungstemperatur.

In der Arbeitsgruppe Photobiotechnologie der Ruhr-Universität Bochum (RUB) forschen wir seit vielen Jahren an eisenhaltigen Enzymen aus einzelligen Grünalgen der Art Chlamydomonas reinhardtii. Unter anderem benutzt die Mikroalge diese Biokatalysatoren zur Bildung von molekularem Wasserstoff (H2) – ein Energieträger, der durch seine Energie liefernde Reaktion mit molekularem Sauerstoff (O2) zum Beispiel als Treibstoff oder zur Stromproduktion dienen kann, wobei als Endprodukt lediglich reines Wasser entsteht.
Unsere Vision ist, einen effizienten Biokatalysator aus der Natur für die Herstellung von Wasserstoff im industriellen Maßstab einzusetzen. Daher untersuchen wir seit Jahren die Wasserstoff produzierenden Enzyme – Hydrogenasen genannt – von Chlamydomonas.
Auch Algen haben Stress
Diese Mikroalgen betreiben normalerweise Photosynthese wie höhere Pflanzen auch, das heißt, sie nutzen die Energie des Sonnenlichts für die Herstellung von Kohlenhydraten und anderen Zellbestandteilen. Unter bestimmten Umweltbedingungen verwendet Chlamydomonas den photosynthetischen Apparat jedoch, um molekularen Wasserstoff zu bilden. Dabei ist das H2-Gas für die Alge ein Abfallprodukt: Sie nutzt es lediglich, um in Stresssituationen überschüssige Energie abzuleiten. Stress bedeutet für den Einzeller zum Beispiel, wenn Nährstoffe wie Schwefel oder Stickstoff fehlen.
Für den Menschen stellt dieses Notfallprogramm der Mikroalge die optimale Form der Energiegewinnung dar. Denn im Prinzip wird einfach aus Wasser und Licht ein effizienter und sauberer Energieträger erzeugt, ganz ohne schädliche Emissionen oder den Abbau von Rohstoffen.
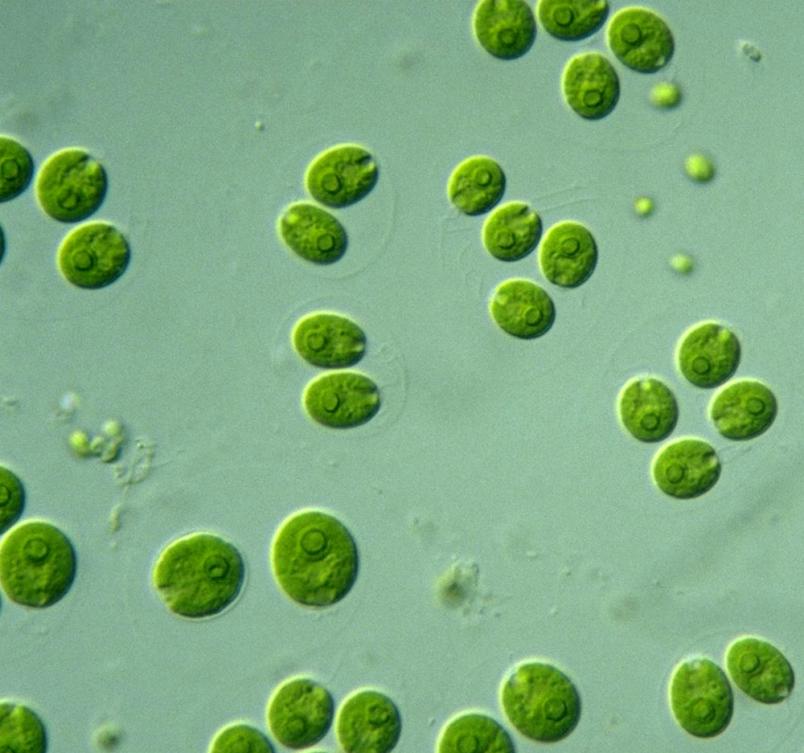
Allerdings lassen sich Grünalgen nicht so leicht dazu bringen, in großem Maßstab einen regenerativen Energieträger herzustellen. Denn Chlamydomonas schaltet bei Stress nur vorübergehend auf photosynthetische H2-Produktion um und bildet nur so lange und so viel Wasserstoff, dass sie überleben kann. Darüber hinaus ist es nicht so einfach, den Einzeller unter Stressbedingungen zu kultivieren, da kubikmeterweise Algen mit ausreichend Licht versorgt werden müssen, um die photosynthetische Wasserstoffproduktion in Gang zu halten.
Die wirtschaftliche Wasserstofferzeugung durch Algen liegt daher nach wie vor in der Zukunft. Diesem Problem nähern wir uns an der RUB auf verschiedenen Wegen. Zum einen haben wir es noch nicht aufgegeben, Wasserstoff mithilfe lebender Grünalgen zu gewinnen. Zum anderen isolieren wir das Hydrogenase-Enzym aus der Alge und testen, ob wir es auch im Reagenzglas zur Wasserstoffproduktion verwenden können.
Stoffwechsel der Algen besser verstehen
Um die Produktionsleistung der lebenden Algen zu steigern, müssen wir den H2-Stoffwechsel und seine Regulation besser verstehen. Wir versuchen daher zu entschlüsseln, wie die Mikroalgen überhaupt merken, dass sie von normaler Photosynthese auf H2-Bildung umschalten müssen, und wie sie die Aktivität der dafür benötigten Gene ändern.

Während eines Projekts, das wir gemeinsam mit Kolleginnen und Kollegen der Universität von Los Angeles in Kalifornien (UCLA) durchgeführt haben, stießen wir auf ein ganz bestimmtes Protein: ein Hämoglobin. Lange kannte man fast ausschließlich das Hämoglobin von Säugetieren, das für den Transport von Sauerstoff sorgt und unserem Blut die rote Farbe gibt. Heute weiß man, dass Menschen und Tiere verschiedene Formen von Hämoglobinen besitzen und dass diese auch in Bakterien, Einzellern und Pflanzen vorkommen. Dabei übernehmen die eisenhaltigen Proteine nicht nur die Funktion von Gas-Transportern, sondern fungieren auch als stoffumsetzende Enzyme.
Welche Rolle das Hämoglobin in Chlamydomonas spielt, wissen wir noch nicht im Detail. Wir haben aber schon festgestellt, dass es unter Stressbedingungen, die die H2-Produktion ankurbeln, lebenswichtig für die Zellen ist. Wenn wir mittels molekularbiologischer Methoden verhindern, dass die Grünalgen ausreichende Mengen des Hämoglobins bilden können, vermehren sie sich unter Stressbedingungen kaum noch.

Diese wichtige Rolle des Hämoglobins scheint mit seiner Fähigkeit zu tun zu haben, Stickstoffmonoxid (NO) zu binden. NO gehört zu der Gruppe der Stickoxide, von denen man häufig im Zusammenhang mit Auspuffgasen und Luftverschmutzung hört. NO übernimmt aber auch in vielen Organismen wichtige Funktionen als Signalmolekül. Es ist ein Botenstoff, der unter anderem die Erweiterung von Blutgefäßen bewirkt.
Die Alge Chlamydomonas reinhardtii benötigt Stickstoffmonoxid, um unter H2-Produktionsbedingungen wachsen zu können. NO ist außerdem wichtig für die Aktivität der Hydrogenase-Gene. Das Chlamydomonas-Hämoglobin reagiert im Reagenzglas sehr stark mit Stickstoffmonoxid, sodass wir momentan davon ausgehen, dass es die Effekte von NO in den Algenzellen vermittelt. Weitere Studien müssen zeigen, wie genau die Wasserstoffproduktion mit den Effekten von Hämoglobin und Stickstoffmonoxid zusammenhängt.
Ein neues Forschungsgebiet
Neben neuen Erkenntnissen über die Regulation des H2-Stoffwechsels in Mikroalgen hat sich hier für uns auch ein neues Forschungsgebiet aufgetan. Wir haben in Chlamydomonas zwölf zum Teil sehr ungewöhnliche Gene entdeckt, die den Bauplan für Hämoglobine enthalten; die Aufgabe dieser Moleküle wollen wir herausfinden. Auch die Rolle von menschlichen Hämoglobinen ist noch nicht vollständig verstanden, obwohl sie sehr wichtig für eine reibungslose Funktion unseres Körpers sind. Erkenntnisse über das Zusammenspiel von Hämoglobin und Stickstoffmonoxid in Chlamydomonas könnten helfen, auch die Prozesse im menschlichen Körper besser zu verstehen. Denn die Grünalge scheint NO auf eine ganz ähnliche Weise als Botenstoff zu nutzen.
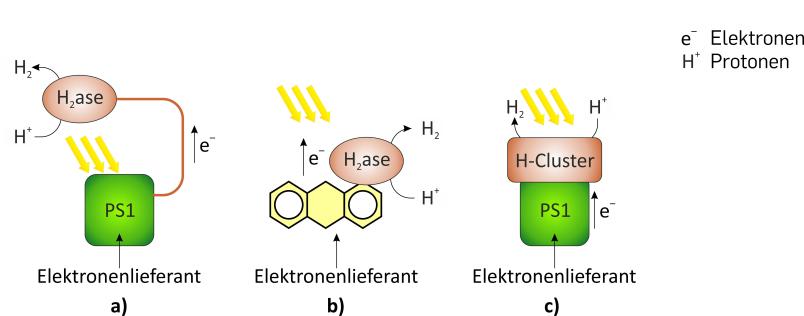
Was die Wasserstoffproduktion angeht, verfolgen wir an der RUB jedoch noch einen ganz anderen Ansatz: Wir holen das H2-bildende Enzym, die Hydrogenase, aus den Algen heraus. Unser Ziel ist, es so zu optimieren, dass wir es im isolierten Zustand nutzen können. Dann könnten wir den komplexen Stoffwechsel der Algenzelle umgehen und auf viel kleinerem Raum große Mengen Wasserstoff erzeugen.
Hürden überwinden
Aber auch hier gilt es, einige Hürden zu überwinden. Ein aus biotechnologischer Sicht großer Nachteil ist die Sauerstoffempfindlichkeit von Hydrogenasen. Ihr eisenhaltiger Co-Faktor, das H-Cluster, reagiert mit Sauerstoff, was ihn irreparabel schädigt. Wir müssen das Enzym also von der Luft fernhalten. Außerdem ist es sehr schwierig, die aktive Hydrogenase in großem Maßstab aus lebenden Zellen zu isolieren. Bisher war das Arbeiten mit Hydrogenasen daher im Forschungsmaßstab und erst recht im industriellen Maßstab nicht gerade einfach, denn man braucht ausreichend große Mengen des isolierten Enzyms. In der Forschung meinen wir mit „großen Mengen“ nur zehn bis 20 Milligramm. Doch aus einem Liter Chlamydomonas-Kultur lassen sich gerade einmal einige Mikrogramm gewinnen.
Vor einigen Monaten jedoch haben wir gemeinsam mit Chemikern aus Grenoble in Frankreich sowie Biophysikern vom Max-Planck-Institut Mülheim ein Verfahren entwickelt, das gleich mehrere Fliegen mit einer Klappe schlägt – möglicherweise ein Meilenstein auf dem Weg zur großtechnischen Wasserstoffproduktion mit Hydrogenasen. Wir stellten eine halbsynthetische Hydrogenase her, aus einer inaktiven chemischen Vorstufe des eisenhaltigen Co-Faktors und aus einem inaktiven Proteingerüst. Die beiden Bestandteile im Reagenzglas zu mischen reichte aus, um einen hochaktiven Katalysator zu erzeugen.
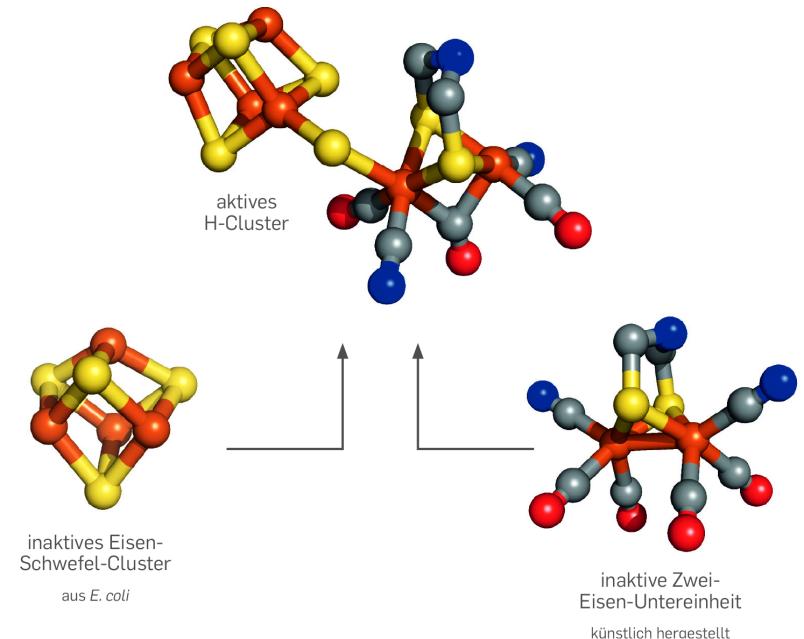
Es ist nicht sehr schwierig, den Co-Faktor der Hydrogenase, das H-Cluster, chemisch nachzubauen, obwohl es zu den komplizierteren biologischen Molekülen gehört. Tatsächlich gelang es Wissenschaftlern schon vor mehreren Jahren, ein künstliches H-Cluster herzustellen. Das Ziel war damals, eine rein chemische Nachahmung – ein sogenanntes Mimic – der gesamten Hydrogenase zu etablieren, die ganz ohne lebende Materie auskommt.
Die Proteinstruktur von Enzymen ist aber in den meisten Fällen wichtig für die katalytische Aktivität eines Co-Faktors, und das nackte H-Cluster-Mimic war im Reagenzglas kaum aktiv. Gemeinsam mit unseren Kolleginnen und Kollegen gelang es uns aber, dieses inaktive Mimic in eine – ebenfalls inaktive – Hydrogenase-Vorstufe ohne Co-Faktor zu integrieren. Dabei nutzten wir zunächst ein natürliches Helferprotein, das in lebenden Zellen am Zusammenbau der Hydrogenasen beteiligt ist. Im Reagenzglas baute dieses Hilfsenzym das künstliche H-Cluster in das Hydrogenase-Gerüst ein, und wir erhielten so eine halbsynthetische Hydrogenase, die im Reagenzglas große Mengen an H2 bildete.
Von den eigenen Ergebnissen überrascht
Kurze Zeit später wiederholten wir die Versuche an der RUB, diesmal allerdings ohne das Helferprotein. Wir gingen eigentlich davon aus, dass der Einbau des Co-Faktors in die Hydrogenase-Vorstufe auf Helferproteine angewiesen ist, aber wir dachten uns: „Man kann’s ja mal versuchen.“ Wir waren selbst überrascht, dass es auch ohne das Hilfsenzym funktionierte! Nun hatten wir ein sehr einfaches System, um funktionstüchtige Hydrogenase im Reagenzglas zu erzeugen: einfach das synthetische H-Cluster mit dem Proteingerüst der Hydrogenase mischen, fertig.
Ganz verzichten können wir auf lebende Zellen zwar immer noch nicht. Denn wir brauchen das Darmbakterium Escherichia coli, um das Proteingerüst herzustellen. Die Arbeit mit E. coli und der inaktiven Hydrogenase-Form ist aber viel einfacher als alles, was wir zuvor versucht haben, und wir können nun schon im Labormaßstab recht schnell große Mengen an hochaktivem Enzym herstellen.

Auch auf anderen Ebenen verspricht das Mimic-System, die Forschung und Anwendung voranzutreiben. In unserer Arbeitsgruppe untersuchen wir, ob kleine Modifikationen des Hydrogenase-Proteingerüsts das Enzym so beeinflussen, dass es weniger empfindlich gegenüber Sauerstoff wird oder mehr Wasserstoff produziert.
Um die Hydrogenase zu optimieren, tauschen wir einzelne Aminosäuren aus und analysieren die Konsequenzen. Meistens reicht es jedoch nicht, nur einen der insgesamt rund 500 Bausteine zu verändern, um deutliche Effekte hervorzurufen. Tauschen wir gleichzeitig mehrere Bausteine aus, müssen wir aber Tausende von Enzymvarianten untersuchen. Auch dies ist viel einfacher, schneller und zuverlässiger, wenn wir mit E. coli arbeiten und das so hergestellte Proteingerüst nachträglich aktivieren. Nicht zuletzt haben wir nun die Möglichkeit, das H-Cluster selbst zu manipulieren und es so vielleicht zu stabilisieren oder unempfindlich gegenüber Sauerstoff zu machen.
Politik und Industrie sind interessiert
Wegen ihres Potenzials, zur Lösung der Energieprobleme beizutragen, haben Hydrogenasen schon länger das Interesse der Politik und Industrie geweckt. Unsere semibiologischen Hydrogenasen und die chemischen Mimics haben nun zum zweiten Mal die VolkswagenStiftung überzeugt, unsere anwendungsbezogene Forschung finanziell zu fördern. In dem aktuell unterstützten Projekt geht es speziell darum, die Hydrogenasen mit chemischen Molekülen zu verknüpfen, welche Lichtenergie für die Wasserstoffproduktion nutzbar machen sollen.
Durch die intensive interdisziplinäre Zusammenarbeit von Biologie, Chemie und Biophysik ergeben sich für die Zukunft spannende Konzepte, um neuartige Katalysatoren auf Biobasis zu generieren. Ähnlich wie in der Lebensmitteltechnologie und der Medizindiagnostik könnten diese halbkünstlichen Enzyme Einsatz finden, um umweltfreundlich Energie zu gewinnen.