Lösungsmittelchemie
Proteine in ihrer natürlichen Umgebung beobachten
Proteine können dafür verantwortilch sein, dass Wirkstoffe von Medikamenten aus den Zielzellen einfach wieder herausgeschleust werden. Dabei kann man ihnen jetzt zuschauen.
Bestimme Medikamente, zum Beispiel gegen Krebserkrankungen, verlieren ihre Wirkung, weil Proteine in der Membran der Zielzelle sie einfach wieder ausschleusen. Ein verantwortliches Transportprotein konnte ein Team der RUB erstmals in seiner natürlichen Umgebung beobachten. Dazu markierten die Forscherinnen und Forscher es mit kleinen Sequenzen von Antikörpern, an denen ein Kontrastmittel angedockt war. Dessen Spin konnten sie mittels Elektronenspinresonanz detektieren und Rückschlüsse auf den Zustand des Proteins ziehen.
Über die Methode berichtet das Team um Prof. Dr. Enrica Bordignon und Dr. Laura Galazzo vom Exzellenzcluster Ruhr Explores Solvation Resolv in Zusammenarbeit mit der Gruppe von Prof. Dr. Markus Seeger von der Universität Zürich in der Zeitschrift PNAS vom 4. Februar 2020.
Nanobodies finden das Protein und binden daran
Bisher konnte man Membranproteine nur isoliert untersuchen, wobei die Gefahr besteht, dass sie ihre für die Funktion ausschlaggebende Gestalt verlieren. Das Team von Resolv konnte sie nun in ihrer natürlichen Umgebung in der Membran von Escherichia-coli-Bakterien beobachten. „Dort ist es sehr eng und voll“, beschreibt Enrica Bordignon. Der Trick des Teams besteht darin, zwei nur wenige Nanometer kleine Sequenzen von Antikörpern als Markierung zu benutzen, sogenannte Nanobodies. „Wir verwenden exakt die Sequenzen, die bestimmte Abschnitte des Proteins erkennen und daran binden können“, erklärt Laura Galazzo.
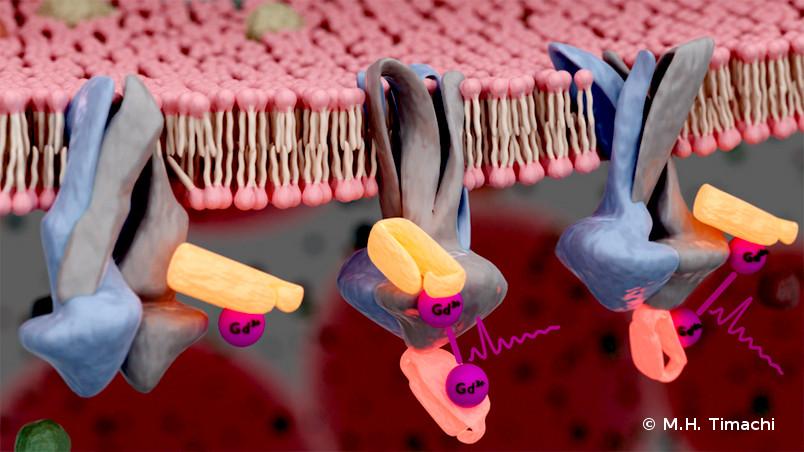
Die Auswahl der richtigen Nanobodies übernahm das Team von Markus Seeger. „Dank der von uns entwickelten Selektionsplattform, die die Immunisierung von Tieren umgeht, kann jedes Labor schnell synthetische Nanobodies für jeden Zweck erzeugen. Das bedeutet einen Schritt zu ihrer Verwendung in der strukturellen Biologie, wie diese Arbeit zeigt“, so Seeger.
An die beiden Nanobodies werden Gadolinium-Atome angehängt. Gadolinium wird auch als Kontrastmittel für Kernspintomografien eingesetzt und kann aufgrund seines Elektronenspins sichtbar gemacht werden. Da sich die so markierten Nanobodies schlecht in Bakterien einschleusen lassen, wurden diese nach außen umgestülpt, sodass das Innere der Membran außen zu liegen kam.
Signal nur bei einer bestimmten Gestalt
„Die Nanobodies binden sofort an die Sequenz des Membranproteins, die sie erkennen, und sind dann auch kaum noch von ihnen zu lösen“, so Enrica Bordignon. Die so behandelten Bakterien untersuchten die Forscherinnen und Forscher dann mittels Elektronenspinresonanz, auf Englisch electron paramagnetic resonance, kurz EPR. „Dabei konnten wir nur dann ein Signal empfangen, wenn sich zwei unserer unterschiedlichen Nanobodies in unmittelbarer Nähe zueinander befanden“, erklärt Laura Galazzo. Das war genau dann der Fall, wenn das Protein die Konformation einnimmt, die Wirkstoffe aus der Zelle herausschleust.