
Biochemie
Schritt für Schritt zum Endprodukt per Enzymkatalyse
Enzyme aus Mikroorganismen können wertvolle chemische Stoffe herstellen. In einer Kaskade geht das auch, wenn sie verschiedene Umgebungsbedingungen brauchen.
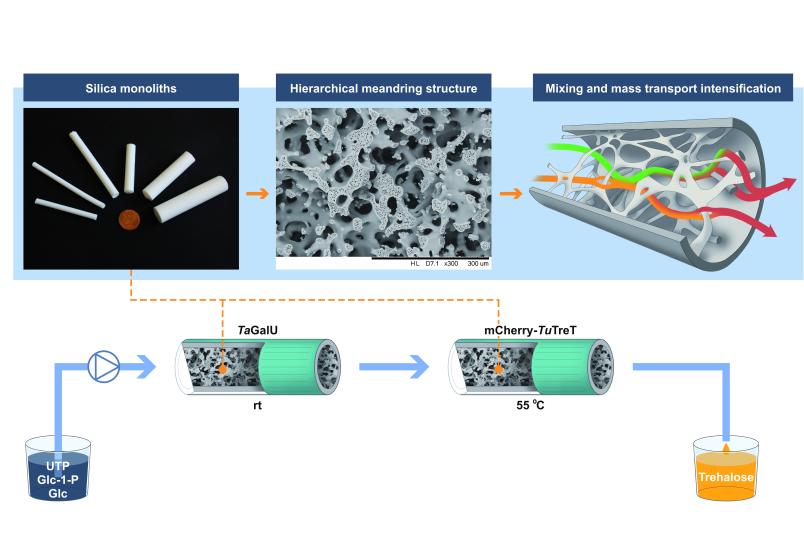
Die Herstellung des Zuckers Trehalose, der als functional food, Additiv in Pharmaprodukten oder in Kosmetika eingesetzt wird, ist für Enzyme Teamarbeit: Eines sorgt für den Bau eines energiereichen Zwischenprodukts (UDP-Glukose), aus dem das zweite dann Trehalose macht. Obwohl Nummer eins bei Raumtemperatur arbeitet, während Nummer zwei über 50 Grad Celsius bevorzugt, funktioniert die Zusammenarbeit dank einer Flusskatalyse. Das konnte das Team von Prof. Dr. Dirk Tischler, Leiter der Arbeitsgruppe Mikrobielle Biotechnologie an der Ruhr-Universität Bochum (RUB) zeigen. Darüber berichtet die Zeitschrift Chemical Engineering Journal vom 8. August 2021. In einem Folgeprojekt wollen die Forschenden das Verfahren optimieren.
Hintereinanderliegende Reaktoren
Enzyme, zum Beispiel aus Bakterien, können verschiedenste Ausgangsstoffe in eine Fülle von Zielprodukten umbauen. Diese Fähigkeit will die sogenannte Weiße Biotechnologie sich zunutze machen, um auf umweltfreundliche Weise Chemikalien herzustellen. Da es manchmal mehrere Katalysatoren und Schritte braucht, um das gewünschte Produkt herzustellen, entwarf das Team um Dirk Tischler in Kooperation mit Gruppen der Technischen Universität Delft, der Technischen Universität Bergakademie Freiberg und der Schlesischen Technischen Universität eine Kaskade zur Flusskatalyse. Aus den Ausgangsstoffen Glukose und Glukose-1-Phosphat (aktivierte Form) und UTP (Uridintriphosphat, biochemischer Energieträger) wurde so in zwei Schritten, die an immobilisierten Enzymen stattfanden, Trehalose. Das erste Enzym hat dabei die Aufgabe, die Glukosemoleküle zu aktivieren, das zweite verknüpft sie. „Da das eine Enzym andere Arbeitsbedingungen benötigt als das andere, haben wir sie in zwei hintereinanderliegenden Reaktoren immobilisiert“, erklärt Dirk Tischler. Auf diese Weise kann man zum Beispiel die Temperatur oder die Verweilzeit der Substrate im Reaktor unabhängig voneinander einstellen. „Es wäre auch denkbar, auf diese Weise nicht nur Zucker miteinander zu verknüpfen, sondern auch beispielsweise medizinische Wirkstoffe an Zucker anzubauen, etwa Antibiotika“, wirft er einen Blick in die Zukunft.
Wiederverwendbare Träger drucken
In einem Folgeprojekt, das er gemeinsam mit der Firma Hirsch Engineering Solutions eingeworben hat und das vom Bundesministerium für Wirtschaft und Energie gefördert wird, geht es jetzt darum, die Kaskade zu optimieren. Ziel ist es zum einen, die Trägermaterialien für die Enzyme zu verbessern. „Die Silikaträger, die wir bisher benutzen, vertragen nicht alle Enzyme gut“, so Tischler. Zudem sind sie oft nicht wiederverwendbar. Kunststoffe, auch aus biologischen Quellen, könnten besser geeignet sein und per 3D-Druck in Form gebracht werden. „Ihre Biokompatibilität haben sie in verschiedenen medizinischen Anwendungen schon unter Beweis gestellt“, sagt der Naturwissenschaftler.
Zum anderen wollen die Projektpartner die Enzymkaskade auch kostengünstiger machen, indem sie eine Kinase einfügen, die am Ende der Reaktion das abgespaltene UDP unter Zuhilfenahme von Polyphosphat zu UTP recycelt. Somit kann die Kaskade von neuem beginnen. „Bislang müssen wir immer neu UTP hinzufügen, um die Kaskade zu starten, das ist relativ teuer“, erklärt Dirk Tischler. „Würde es uns gelingen, das mittels Polyphosphat zu recyceln, würde das die Kosten erheblich senken.“





