Proteinforschung
Wie Pflanzen die Strukturen für die Fotosynthese aufbauen
Forschende haben neue Erkenntnisse über das Protein gewonnen, das an der Entstehung von Thylakoidmembranen beteiligt ist. Sie könnten helfen, widerstandsfähigere Pflanzen zu züchten, die dem Klimawandel die Stirn bieten.
Der Klimawandel verändert die Erde rasant, ein massiver Verlust der Biodiversität und knappe Nahrungsmittel in manchen Teilen der Erde sind die Folgen. Pflanzen, die den harschen Umweltbedingungen besser widerstehen könnten, besitzen das Potenzial, die Probleme abzumildern. Ein internationales Forschungsteam hat neue Einblicke gewonnen, wie das Schlüsselprotein VIPP1 – kurz für Vesicle-inducing protein in plastids 1 – in den Aufbau von Strukturen involviert ist, die für die Fotosynthese verantwortlich sind. Die Forscherinnen und Forscher, darunter Dr. Till Rudack von der RUB, hoffen, dass diese Erkenntnisse helfen können, Pflanzen zu designen, die mehr CO2 binden und besser vor Umweltstress geschützt sind. Sie berichten in der internationalen Top-Zeitschrift „Cell“ vom 8. Juli 2021, in der das Thema die Titelstory ist.
Cyanobakterien, Algen und Pflanzen können Lichtenergie in biochemische Energie umwandeln und dabei CO2 aus der Atmosphäre fixieren. Die Fotosynthese findet dabei in Chloroplasten in den sogenannten Thylakoidmembranen statt. Wie diese Membranstrukturen entstehen und sich als Antwort auf veränderte Umgebungsbedingungen anpassen, interessierte die Forschenden in der vorliegenden Arbeit. Sie nahmen dazu das Protein VIPP1 unter die Lupe, das in fast allen Fotosythese treibenden Organismen vorkommt.
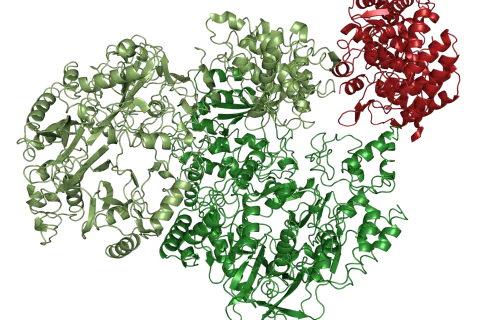
Proteinstruktur und -funktion analysiert
Seit Jahrzehnten ist bekannt, dass VIPP1 eine entscheidende Rolle beim Aufbau der Thylakoidmembranen spielt, aber wie genau es diese Funktion ausübt, blieb ein Mysterium – bis jetzt. In der Cell-Publikation veröffentlichten die Forschenden erstmals hochaufgelöste Strukturen von VIPP1, die sie mittels Kryo-Elektronenmikroskopie gewannen. Mit verschiedenen Methoden analysierten sie außerdem die Funktion des Proteins und zeigten, dass es eine verwobene Struktur bildet, die die Membranen formt. Sie konnten außerdem den Prozess beobachten, mit dem das Protein die Thylakoidmembranen an der Chloroplastenhülle andockt.

„Die unerwartete Entdeckung der ungewöhnlichen Nukleotidbindetasche war ein Schlüsselereignis auf Seiten der Proteinmodellierung“, so Till Rudack, der die Struktur-Modellierung angeleitet hat. Auf Grundlage der nun zur Verfügung stehenden Struktur können in Zukunft mittels biomolekularer Simulationen nicht nur die Vorgänge in der Bindetasche genauer untersucht werden, sondern auch viele weitere der oben beschriebenen Prozesse. Der Einfluss einiger anhand des Strukturmodells vorgeschlagener funktioneller Gruppen konnte bereits in der Arbeit durch erste Experimente bestätigt werden.
Kooperationspartner
Für die Arbeiten kooperierte das Team um Ben Engel vom Helmholtz Pioneer Campus in München, die Gruppe um Michael Schroda von der Technischen Universität Kaiserslautern, das Team um Jan Schuller von der Philipps-Universität Marburg sowie Kolleginnen und Kollegen von der Ludwig-Maximilians-Universität München, der Okayama University, der McGill University, der RUB und dem Max-Planck-Institut für Biochemie.
„Unsere Studie erschließt viele neue Wege und nutzt eine Vielzahl von Techniken. Das war nur dank der enormen gemeinsamen Anstrengungen der Forschenden in unserem internationalen Konsortium möglich“, sagt Ben Engel vom Helmholtz Pioneer Campus des Helmholtz Zentrums München.