Interview Antibiotika aus dem Reich der Bakterien
Experten sind sicher, dass es unentdeckte antibiotische Substanzen gibt. Sie machen sich bereit, sie zu finden.
Angesichts des seit Jahren bekannten Problems multiresistenter Bakterien, die Schätzungen des Robert-Koch-Instituts zufolge jedes Jahr 10.000 bis 20.000 Menschen allein in Deutschland das Leben kosten, mutet es seltsam an, dass es seit etwa 15 Jahren fast keine Forschung an neuen Antibiotika in großen Pharmaunternehmen mehr gibt. Mit dem Center für systembasierte Antibiotikaforschung, kurz Cesar, entsteht eine in Deutschland einzigartige Infrastruktur für die Suche nach neuen, antibiotisch wirksamen Substanzen. Prof. Dr. Julia Bandow, Leiterin des Lehrstuhls Angewandte Mikrobiologie an der RUB, koordiniert die Einrichtung, die gemeinsam mit dem Lead Discovery Center, Dortmund, aufgebaut wird.
Im Interview schildert sie die Herangehensweise.
Frau Professor Bandow, warum liegt die Antibiotikaforschung schon so lange brach?
Die Politik war lange der Ansicht, dass die Antibiotikaentwicklung eine Domäne der Pharmaindustrie sei. Die Industrie wiederum hatte leider in großem Stil aufs falsche Pferd gesetzt: Man hat jahrelang nach Wirkstoffen gesucht, die gezielt gegen einzelne lebensnotwendige Proteine von Erregern gerichtet sind, und ist auch durchaus fündig geworden. Aber wenn man nur ein einziges Ziel adressiert, kann sich durch eine spontane Mutation des verantwortlichen Gens schnell eine neue Resistenz entwickeln. Bisher ist keiner dieser Wirkstoffe auf den Markt gekommen.

Ein weiteres Problem war, dass viele Stoffe zwar im Reagenzglas die Funktion der Bakterienproteine stören, dass sie aber entweder nicht in Zellen gelangen können oder die Zellen sie mithilfe molekularer Pumpen nach draußen befördern. So hat die Industrie lange Zeit hauptsächlich neue Derivate von bekannten Antibiotika auf den Markt gebracht. Besonders tragisch ist, dass das auf die gesamte Branche weltweit zutrifft.
Inwiefern verfolgen Sie mit Cesar einen anderen Ansatz?
Uns geht es um zwei Aspekte: Zum einen wollen wir neue Substanzen finden, das heißt neue Stoffklassen als Ersatz für die vorhandenen, die zunehmend nicht mehr funktionieren. Dafür müssen wir sie ausfindig machen und in ausreichender Menge gewinnen, um sie testen und gegebenenfalls auch Derivate entwickeln zu können.
Der andere Aspekt ist die Analyse der Wirkmechanismen: Wir wollen wissen: Was tun diese Substanzen? Wirken sie nur gegen Bakterien oder auch gegen menschliche Zellen?

Wir wenden dabei globale Methoden an, das heißt, wir schauen uns sämtliche Stoffwechselprodukte an, die Mikroorganismen ausscheiden, und sämtliche Proteine, die sie synthetisieren. Da Mikroorganismen in ihren Lebensräumen miteinander um Ressourcen konkurrieren, geben sie Substanzen ab, die ihre Konkurrenten hemmen, also antibiotische Wirkung haben.
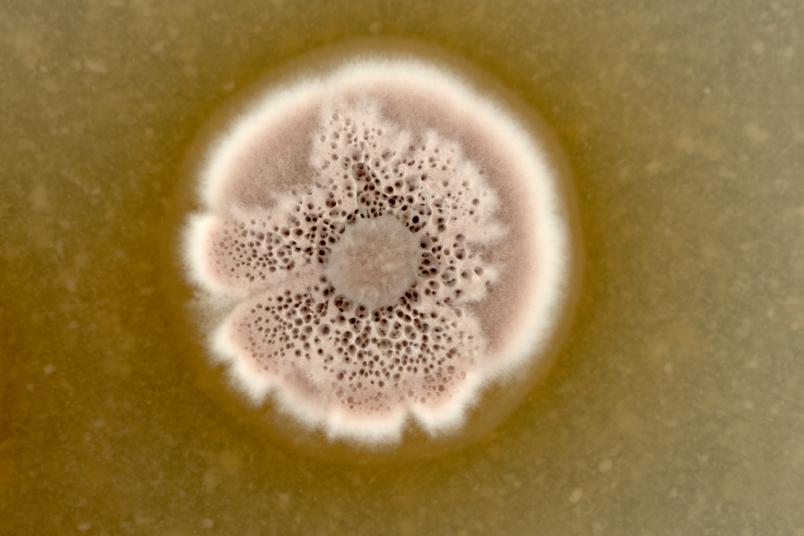
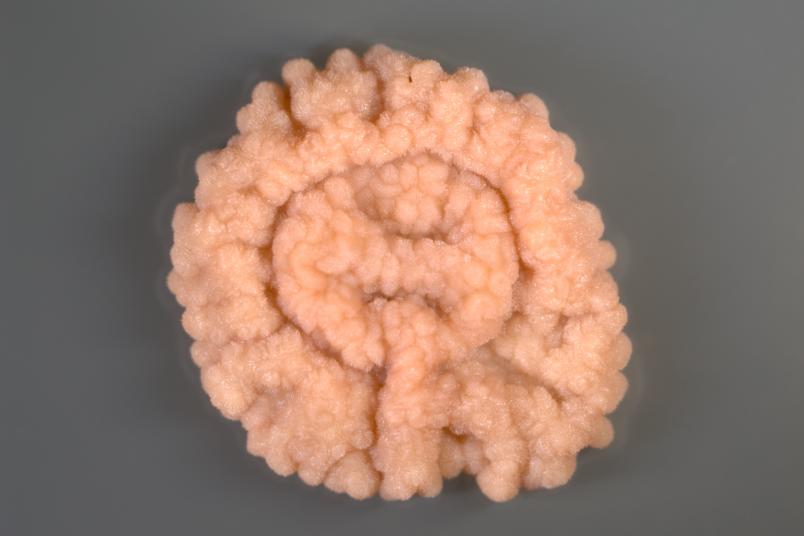
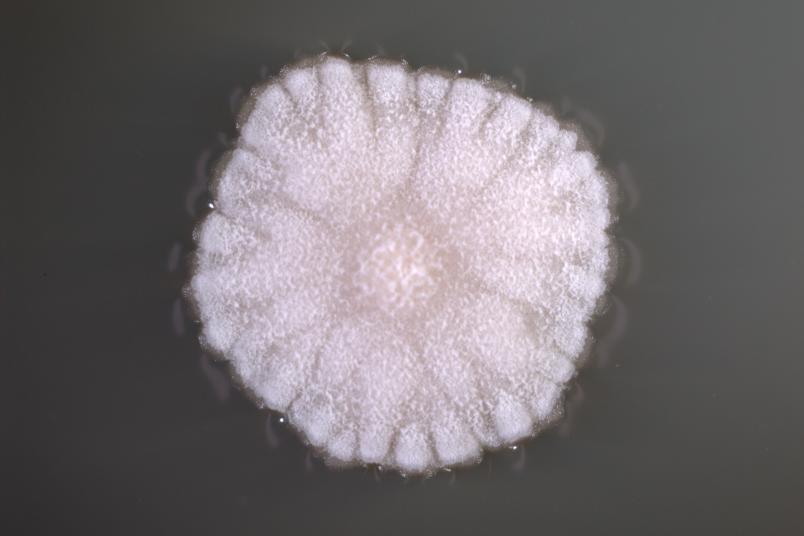
Wir untersuchen Streptomyceten als Produzenten. Das sind im Boden lebende Bakterien, die besonders gute Chemiker sind: Sie geben sehr viele Substanzen ab. Fast alle zurzeit als Antibiotika genutzten Naturstoffe werden entweder von dieser Bakteriengruppe oder von Pilzen hergestellt. Da sich die Nachweismethoden in den vergangenen Jahren erheblich verbessert haben, hoffen wir, bisher noch nicht bekannte weitere Wirkstoffe zu entdecken. Dazu gibt es ermutigende Vorarbeiten: In einer Arbeit von 2018 hat Christoph Senges aus meiner Arbeitsgruppe über 1.000 Substanzen detektieren können, die ein einziger Streptomyceten-Stamm herstellen kann.
Wie kommt man dieser ungeheuren Menge an Substanzen dann bei?
Nehmen wir zum Beispiel Streptomyces chartreusis, der 128 Biosynthesecluster zur Synthese von Naturstoffen hat. Mithilfe vergleichender genetischer Analysen ist das Ganze schwer zugänglich, denn wo sollten wir anfangen? Die Produkte der meisten Biosynthesecluster lassen sich nicht vorhersagen.
In Cesar wählen wir einen anderen Ansatz: Wir schauen uns die Stoffwechselprodukte an und clustern strukturell verwandte. Die Idee ist, von den Clustern eine stellvertretende Substanz zu reinigen, um ihre Struktur aufklären zu können und sie hinsichtlich ihrer antibiotischen Wirkung zu charakterisieren. Von diesem Vertreter ausgehend können wir dann das entsprechende Cluster an Substanzen annotieren.
Noch ist vieles Spekulation, zum Beispiel: Wenn viele Varianten einer Stoffgruppe gebildet werden, hat diese Gruppe vielleicht eine besonders große Bedeutung für den Produzenten?
Im ersten Schritt geht es bei Cesar aber um den Aufbau der Infrastruktur.

Was bedeutet das?
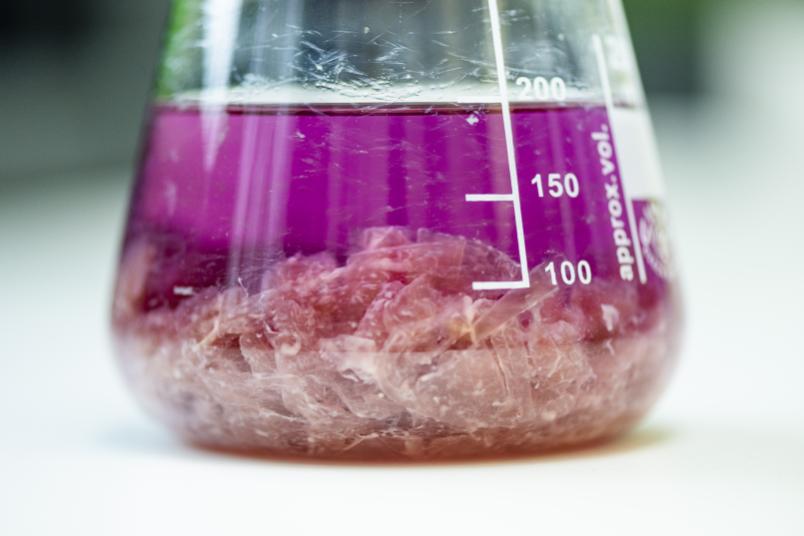
Wir bekommen Geräte für die Analyse des Metaboloms von Mikroorganismen, also sämtlicher Produkte, die sie ausscheiden, und für die Analyse des Proteoms, also sämtlicher Proteine, die sie bilden. Darüber hinaus stehen weitere Geräte für die Aufreinigung zur Verfügung, zum Beispiel Schüttler, Zentrifugen und Chromatographie-Systeme. Die Geräte müssen in Workflows eingebunden werden, mit denen die einzelnen experimentellen Etappen absolviert werden. Mit der Infrastruktur sollen Voraussetzungen für Forschungs- und Entwicklungsprojekte geschaffen werden, die dann der Entdeckung und Charakterisierung neuer Substanzen gewidmet sind.
Wir wollen auch Erfahrungen mit der Aufreinigung von Substanzen sammeln: Erfahrungsgemäß ist es so, dass man 80 Prozent der unerwünschten Substanzen recht leicht entfernen kann, die restlichen 20 Prozent aber sind hartnäckiger. Hier braucht man mehrere Trennmethoden, die unterschiedliche Eigenschaften von Substanzen für deren Trennung ausnutzen.
Da wir ursprünglich aus der Biologie kommen, sind wir in der Proteomik und Wirkmechanismusanalyse sehr gut aufgestellt, wollen nun aber auch unsere Expertise in der Chemie erweitern, denn jede Substanz hat ihre eigenen Herausforderungen.
Sind Sie zuversichtlich, dass es gelingen wird, neue Antibiotika zu finden?
Ich bin sehr sicher, dass es bisher unentdeckte Stoffgruppen gibt, die antibiotisch wirken, und dass wir sie finden können.