
Proteinforschung
Der Computer als Mikroskop
Schalterproteine sind überall im Körper aktiv und häufig am Entstehen von Krankheiten beteiligt. Bochumer Forscher haben neue Einblicke in ihre Funktionsweise erlangt – dank einer besonderen Methode.
Mit einer Kombination aus Infrarotspektroskopie und Computersimulationen haben Forscher der RUB neue Einblicke in die Funktionsweise von Schalterproteinen gewonnen. Dank hoher zeitlicher und räumlicher Auflösung bewiesen sie unter anderem den entscheidenden Beitrag eines Magnesiumatoms für das An- und Ausschalten der sogenannten G-Proteine.
G-Proteine sind zum Beispiel am Sehen, Riechen, Schmecken und an der Blutdruckregulation beteiligt. Sie sind Angriffspunkt für viele Medikamente. „Ein detailliertes Verständnis ihrer Funktionsweise ist daher nicht nur von akademischem Interesse“, sagt Prof. Dr. Klaus Gerwert, Leiter des Lehrstuhls für Biophysik. Er berichtet über die Ergebnisse gemeinsam mit seinen Bochumer Kollegen Privatdozent Dr. Carsten Kötting und Daniel Mann im Biophysical Journal. Die Zeitschrift widmete dem Thema in der Ausgabe vom 10. Januar 2017 die Titelgeschichte.
G-Proteine als Krankheitsquelle
An alle G-Proteine kann das Molekül GTP binden. Spaltet ein Enzym eine Phosphatgruppe vom gebundenen GTP ab, wird das G-Protein ausgeschaltet. Dieser Prozess läuft innerhalb von Sekunden im aktiven Zentrum der Enzyme ab. Funktioniert er nicht, kann das schwere Krankheiten auslösen, etwa Krebs oder Cholera.
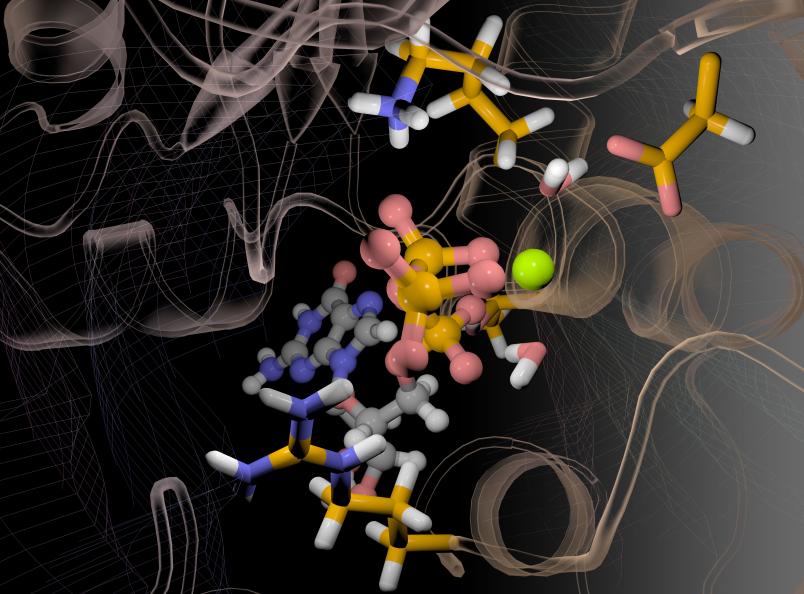
Damit der Schaltprozess stattfinden kann, muss ein Magnesiumatom im aktiven Zentrum des Enzyms vorhanden sein. Das Forscherteam beobachtete erstmals direkt, wie das Magnesium Geometrie und Ladungsverteilung seiner Umgebung beeinflusst. Nach dem Ausschalten verbleibt das Atom in der Bindetasche des Enzyms. Bislang waren Forscher davon ausgegangen, dass das Magnesium die Tasche nach dem Schaltprozess verlässt.
Möglich machte die Erkenntnisse eine am RUB-Lehrstuhl für Biophysik entwickelte Methode. Sie erlaubt, enzymatische Prozesse mit hoher zeitlicher und räumlicher Auflösung in ihrem natürlichen Zustand zu verfolgen. Es handelt sich dabei um eine besondere Form der Spektroskopie, die zeitaufgelöste Fourier-Transform-Infrarot-Differenzspektroskopie.
Allerdings geben die damit gemessenen Daten keine Auskunft darüber, an welcher Stelle des Enzyms ein Prozess gerade stattfindet. Diese Information gewinnen die Forscher durch quantenmechanische Computersimulationen von Strukturmodellen. „Erst mithilfe der Computersimulation können wir die in den Infrarotspektren versteckten Informationen decodieren“, erklärt Carsten Kötting. So wird der Computer quasi zum Mikroskop.





