Biochemie
Alzheimer im Mini-Gehirn
Die Ursachen der Erkrankung liegen größtenteils im Dunkeln. An Gehirn-Organoiden aus Stammzellen wollen Forscher sie entlarven.
Die meisten Fälle von Demenz gehen auf die Alzheimer-Krankheit zurück. Über die Ursachen der Erkrankung weiß man wenig. Fest steht, dass sich im Gehirn von Alzheimer-Patienten Plaques aus fehlgefalteten Proteinen bilden und dass vermehrt Nervenzellen des Gehirns absterben.
„Erstaunlich ist aber, dass diese Plaques und der Verlust von Nervenzellen nicht zwangsläufig mit den Symptomen von Alzheimer wie Vergesslichkeit einhergehen müssen“, sagt Dr. Thorsten Müller, Leiter der Arbeitsgruppe Cell Signalling am Lehrstuhl Molekulare Biochemie der RUB. „Untersuchungen an hochbetagten Nonnen haben ergeben, dass sie bis zu ihrem Tod fast unbeeinträchtigt ihren täglichen Verrichtungen nachgehen konnten, obwohl – wie sich später zeigte – in ihrem Gehirn die für Alzheimer typischen Plaques aufzufinden waren.“
Wie schädlich sind die Plaques wirklich?
Thorsten Müller und sein Team haben andere Auffälligkeiten als Ursache für die Erkrankung in Verdacht: Vor einigen Jahren gelang es ihnen nachzuweisen, dass sich neben den Plaques außerhalb von Nervenzellen auch in den Kernen der Zellen womöglich schädliche Proteinreste ansammeln. Sie könnten dazu führen, dass die Nervenzellen absterben.
„Ausgangssubstanz für beides ist das amyloide Vorläuferprotein APP“, erklärt Thorsten Müller. Das Protein ist eingebettet in die Zellmembran der Nervenzellen, aus der es sowohl außen als auch innen herausragt. Das Protein wird durch Sekretasen gespalten, normalerweise nur einmal nahe der Mitte. Der innerhalb der Zelle abgespaltene Teil ist instabil und zerfällt.
Bei Alzheimer-Patienten wird das Protein zweimal gespalten und zerfällt dadurch in drei Teile. Die mittleren Teilstücke mehrerer dieser Spaltungen verklumpen miteinander und bilden die für Alzheimer typischen Plaques außerhalb der Nervenzellen. Der abgespaltene Teil im Inneren der Zelle ist stabil. Seine Interaktion mit einem anderen Protein namens FE65 führt über Zwischenschritte letztlich dazu, dass dieser Rest in den Zellkern wandert. Dort sammeln sich mit der Zeit solche Reste an und bilden Komplexe. „In Zellkulturexperimenten führt das dazu, dass die Zelle abstirbt“, so Müller.
Mit der Schlussfolgerung, dass das tatsächlich der Weg ist, auf dem Alzheimer entsteht, ist er aber sehr vorsichtig. Denn zwischen Zellkultur und lebendem Gehirn besteht ein großer Unterschied.
„In Zellkultur setzen wir zum Beispiel Unmengen APP ein, um unsere Untersuchungen durchzuführen“, erklärt er. „Die Tests laufen also unter künstlichen Bedingungen ab, die mit den physiologischen Verhältnissen nichts zu tun haben.“ Hinzu kommt, dass mikroskopische Untersuchungen nur an fixierten und angefärbten Nervenzellen möglich sind, die nicht mehr leben. Das hat es bisher unmöglich gemacht zu beobachten, wann und unter welchen Bedingungen sich welche Proteine und Proteinbruchstücke wohin bewegen.

Genau das verspricht eine neue Methode, deren Nutzung Thorsten Müller und sein Team erwartungsvoll entgegensehen. Sogenannte Organoide aus induzierten pluripotenten Stammzellen – Stammzellen, die man aus einem erwachsenden Organismus gewinnen kann – funktionieren wie ein Mini-Gehirn. „Man bringt eine Stammzelle dazu, sich zu Gehirnzellen auszudifferenzieren und lässt sie in einer Nährlösung wachsen“, erklärt Thorsten Müller. „Nach einiger Zeit bilden sich einige Millimeter große, gehirnähnliche Strukturen aus.“ Etwa drei Monate lang funktioniert das System wie ein kleines Gehirn, dann beginnt es von innen heraus abzusterben, weil die Nährlösung nicht mehr bis zur Mitte vordringen und es daher nicht mehr versorgen kann. Ein jetzt erforderliches Gefäßsystem bildet sich nicht aus. Die Nervenzellen arbeiten aber wie in echten Gehirnen. Mit verschiedenen Tricks können die Forscher die Mini-Gehirne auch künstlich altern lassen. Das gelingt zum Beispiel durch oxidativen Stress, der sich durch die Zugabe von Wasserstoffperoxid hervorrufen lässt, oder durch UV-Bestrahlung, die zu vermehrten Schäden im Erbgut führt.
Der besondere Kniff
Der besondere Kniff der Bochumer Gruppe liegt darin, dass sie die Stammzellen, aus denen die Mini-Gehirne entstehen, genetisch verändern. „Wir nutzen dafür die Crispr/Cas-Methode, die sogenannte Genschere“, erläutert Thorsten Müller. „Wir schalten aber nicht einfach einzelne Gene aus, wie das viele andere machen, sondern wir fügen gezielt Bestandteile ein.“

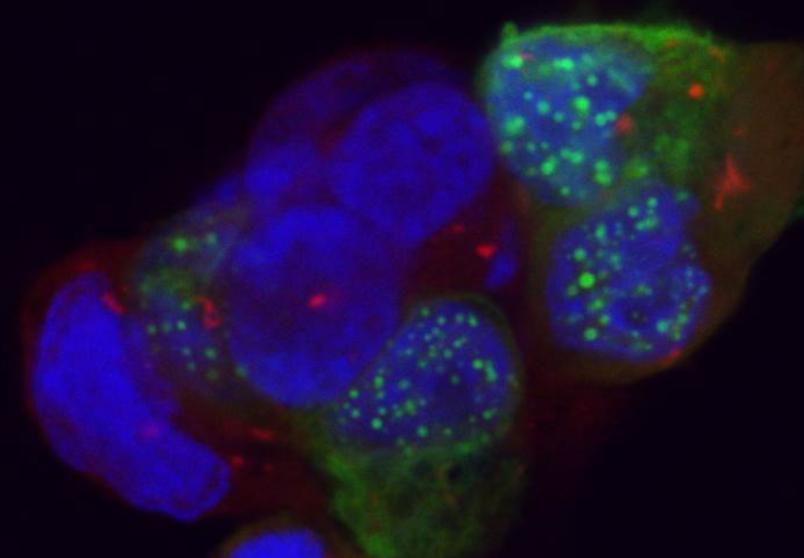
Dabei handelt es sich um Marker wie zum Beispiel das grün fluoreszierende Protein, kurz GFP, oder andersfarbige Markierungssequenzen. Indem die Forscher diese verschiedenfarbigen Marker beispielsweise genau an den Anfang und das Ende der Gensequenz einfügen, die den Bauplan für das APP enthält, können sie später genau verfolgen, wohin sich das Protein oder seine gespaltenen Teile bewegen.
Tierversuche unnötig machen
„Solche Beobachtungen können wir dank der Organoide am lebenden System machen. Wir müssen nichts mehr fixieren und anfärben“, so Thorsten Müller. „Wir könnten also unter dem Mikroskop zum Beispiel live verfolgen, wie lange das ganze APP ungespalten vorliegt, wann es wo gespalten wird und wohin sich die Spaltprodukte bewegen.“ Das erlaubt es erstmals, die in Zellkultur gewonnenen Ergebnisse am lebenden System zu überprüfen. Da man auch andere Gene mit Markern versehen kann, funktioniert das Ganze wie ein Baukasten. Je nachdem, welche Bestandteile markiert werden, lassen sich alle Einzelkomponenten beobachten. So hoffen die Forscher, ergründen zu können, woraus die Aggregate in den Zellkernen wirklich bestehen, und was genau für ihre Wanderung in den Zellkern sorgt.
„Mit den gehirnähnlichen Geweben, die im Labor gezüchtet werden, haben wir nun die Chance, für die Alzheimerforschung, die aktuell wieder ganz am Anfang steht, neue Erkenntnisse zu gewinnen“, erklärt Thorsten Müller. Nicht zuletzt kann ein solches System viele Tierversuche unnötig machen, auf die Forscher mangels Alternativen zurückgreifen mussten.